Mundo
Entenda como funciona o novo remédio contra Alzheimer aprovado nos EUA
O medicamento ainda não foi aprovado fora dos Estados Unidos, mas a fabricante, Biogen, entrou com pedido de revisão regulatória no Brasil, União Europeia e Japão, entre outros locais.
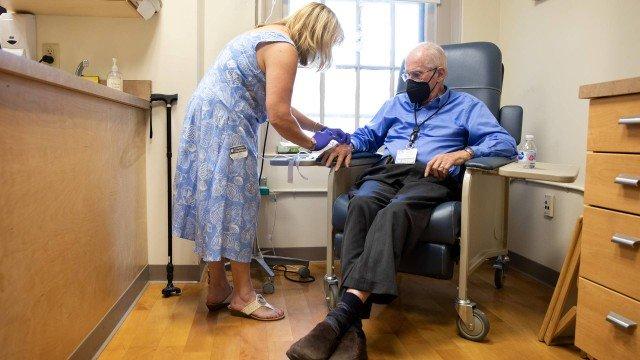
Estudo mostra que a droga pode retardar o declínio cognitivo em doentes na fase inicial. (Foto: Kayana Szymczak/The NYT)
A agência reguladora Food and Drug Administration (FDA), dos Estados Unidos, aprovou ontem um novo medicamento para a doença de Alzheimer, o primeiro em quase duas décadas. A decisão foi tomada apesar da oposição do comitê consultivo independente da agência e de alguns especialistas, que afirmaram não haver evidências suficientes de que a droga possa ajudar os pacientes. Cerca de 30 milhões de pessoas em todo o mundo têm Alzheimer, um número que deve dobrar até 2050.
O medicamento aducanumab, com nome comercial Aduhelm, é uma infusão intravenosa de dose mensal destinada a retardar o declínio cognitivo em pessoas nos estágios iniciais da doença, com problemas leves de memória e pensamento. É o primeiro tratamento aprovado nos EUA para atacar o processo da doença, em vez de apenas atuar sobre os sintomas de demência.
O medicamento ainda não foi aprovado fora dos Estados Unidos, mas a fabricante, Biogen, entrou com pedido de revisão regulatória no Brasil, União Europeia e Japão, entre outros locais.
O FDA concedeu a aprovação com a condição de que a fabricante conduza um novo ensaio clínico. Durante os vários anos que pode levar para que o estudo seja concluído, o medicamento estará disponível para os pacientes nos EUA. Se o estudo pós-comercialização, denominado ensaio de fase 4, não mostrar que o medicamento é eficaz, o FDA pode rescindir sua aprovação.
Grupos de defesa de pacientes fizeram lobby para a aprovação do medicamento porque existem poucos tratamentos disponíveis para a condição debilitante e outros medicamentos em testes clínicos, embora mais promissores, estão a três ou quatro anos de uma possível aprovação.
O comitê consultivo do FDA e especialistas — incluindo médicos que trabalharam nos ensaios clínicos com o aducanumab — disseram que as evidências levantam dúvidas significativas sobre se a droga é realmente eficaz. Eles também disseram que mesmo se o aducanumab pudesse retardar o declínio cognitivo em alguns pacientes, o benefício sugerido pelas evidências seria tão pequeno que não superaria o risco de inchaço ou hemorragia cerebral que a droga apresentou nos testes.
Michel Vounatsos, presidente-executivo da Biogen, disse que a empresa acredita que a droga “transformará o tratamento de pessoas que vivem com a doença de Alzheimer e estimulará a inovação contínua nos próximos anos”.
Aprovação acelerada
O FDA autorizou o medicamento em um programa de “aprovação acelerada”, aplicado a terapias para alguns tipos de câncer e outras doenças graves para as quais há poucos tratamentos ou nenhum.
Os ensaios de Alzheimer são difíceis de conduzir porque muitas vezes é difícil recrutar participantes suficientes. Como a condição pode progredir muito gradualmente, os testes precisam ser extensos e continuar por muitos meses para verificar se um medicamento está diminuindo o declínio cognitivo.
— Não há como recuperar a oportunidade de entender se o produto realmente funciona ou não na configuração pós-aprovação — afirmou G. Caleb Alexander, epidemiologista, especialista em segurança e eficácia de medicamentos da Escola de Saúde Pública Johns Hopkins Bloomberg e membro do comitê consultivo do FDA.
O aducanumab é um anticorpo monoclonal que tem como alvo uma proteína, a amiloide, que se aglomera em placas no cérebro de pacientes com Alzheimer e é considerada um biomarcador da doença. Uma questão em que os críticos e os defensores da aprovação concordam é que a droga reduz substancialmente os níveis de amiloide. O FDA diz que o efeito do medicamento em um biomarcador o qualificou para a aprovação acelerada.
Ainda assim, reduzir a amiloide não é a mesma coisa que desacelerar os sintomas de demência. Ao longo de mais de duas décadas, muitos medicamentos redutores de amiloide não conseguiram tratar os sintomas, algo que, dizem especialistas, tornou especialmente importante que os dados do aducanumab sejam convincentes.
Funcionários da Biogen disseram que a droga forneceu suporte há muito aguardado para a teoria de que atacar a amiloide pode ajudar se isso for feito a tempo. Os defensores da aprovação também disseram que é possível que a eliminação da proteína logo no início do processo possa ajudar a controlar a doença no futuro, proporcionando benefícios adicionais além do declínio inicial ligeiramente atrasado. A suposição, no entanto, não foi testada.
Embora os ensaios para o aducanumab tenham sido conduzidos em pacientes com comprometimento cognitivo leve ou Alzheimer em estágio inicial com níveis de amiloide acima do normal no cérebro, o rótulo do FDA para a droga não contém tais restrições de uso. Ele diz, apenas, que o medicamento é “para o tratamento da doença de Alzheimer”.
Estudos controversos
O principal ponto de controvérsia sobre o aducanumab envolve dois estudos feitos de fase 3 com resultados que divergem: um sugeriu que a droga diminuiu ligeiramente o declínio cognitivo, enquanto o outro estudo não mostrou nenhum benefício.
A Biogen informou, depois, que havia analisado dados adicionais e concluído que, em um dos testes, uma alta dose de aducanumab poderia atrasar o declínio cognitivo em 22%, ou cerca de quatro meses em 18 meses. Na medição primária do ensaio, a dose alta pareceu diminuir o declínio em 0.39 em uma escala de 18 pontos de avaliação de memória, habilidades de resolução de problemas e funções. Uma dose mais baixa nesse ensaio e doses altas e baixas no outro não mostraram benefício estatisticamente significativo em relação ao placebo.
Na reunião do comitê consultivo do FDA, em novembro de 2020, não houve unanimidade sobre as conclusões. Após uma forte rejeição de membros do comitê, o FDA estendeu o prazo de decisão em três meses e buscou informações adicionais da Biogen, não reveladas.
Stephen Salloway, pesquisadora e consultora da Biogen, disse que, embora entendesse as preocupações sobre os dados, “a totalidade das evidências favorece a aprovação do FDA, e ela abrirá a porta para uma nova era de tratamento para a doença de Alzheimer”.
Alguns especialistas temem que a aprovação do aducanumab pelo FDA possa reduzir os padrões para medicamentos futuros, permitindo que cheguem ao mercado antes que os especialistas estejam convencidos de que os benefícios superam os riscos.
Os riscos com aducanumab envolvem inchaço ou hemorragia cerebral experimentados por cerca de 40% dos participantes do ensaio de fase 3 que receberam a dose alta. A maioria era assintomática ou tinha dores de cabeça, tonturas ou náuseas. Os efeitos fizeram com que 6% dos usuários de altas doses interrompessem o tratamento. Nenhum participante da fase 3 morreu, mas um participante do ensaio de segurança, sim.
As informações são do Extra.
Não deixe de curtir nossa página no Facebook, siga no Instagram e também no X.


















Faça um comentário