Brasil
Gerência da Anvisa recomenda CoronaVac e AstraZeneca; diretores vão avaliar
Agora, cinco diretores da Anvisa avaliarão a recomendação, ainda hoje, no decorrer da reunião que deve ser finalizada no final da tarde.
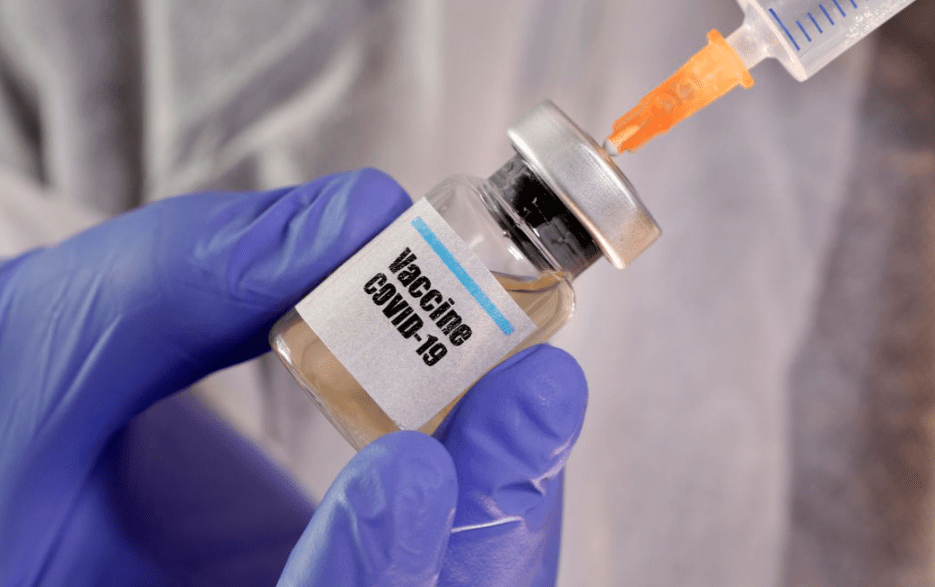
A gerência técnica da Anvisa (Agência Nacional de Vigilância Sanitária) recomendou hoje a liberação do uso emergencial no Brasil das vacinas contra covid-19 CoronaVac, produzida pelo Instituto Butantan com o laboratório chinês Sinovac, e AstraZeneca, desenvolvida pela Universidade de Oxford com a Fiocruz. As informações são do UOL.
Agora, cinco diretores da Anvisa avaliarão a recomendação, ainda hoje, no decorrer da reunião que deve ser finalizada no final da tarde. A Anvisa diz que a decisão sobre ambas as vacinas vai se basear em pareceres de áreas técnicas e que, se aprovadas, serão usadas preferencialmente em programas de saúde pública.
Com relação à CoronaVac, o gerente-geral de Medicamentos e Produtos Biológicos da Anvisa, Gustavo Mendes, afirmou que a vacina teve o dado de imunogenicidade considerado não adequado, mas, tendo em vista a necessidade brasileira, recomendou a aprovação do imunizante.
“A recomendação, como área técnica, é que, tendo em vista o cenário da pandemia, aumento do número de casos e ausência de alternativas terapêuticas, a gerência recomenda a aprovação do uso emergencial da CoronaVac, com acompanhamento das incertezas que ainda temos e reavaliação periódica”, disse Mendes.
Mendes não tem poder de voto. Vão decidir cinco diretores da Anvisa: Antonio Barra Torres, que é diretor-presidente da Anvisa, a relatora dos pedidos, Meiruze Sousa Freitas, e os demais diretores Cristiane Rose Jourdan Gomes, Romison Rodrigues Mota e Alex Machado Campos.
Já com relação à AstraZeneca, Mendes também afirmou que “com a mesma perspectiva, recomendamos a aprovação, condicionada ao monitoramento de incertezas apontadas e reavaliação periódica”.
Anvisa decide se autoriza uso emergencial de CoronaVac e vacina de Oxford Reunião da Anvisa
O foco da Anvisa na reunião de hoje é analisar a eficácia e a segurança das vacinas, de acordo com a própria agência reguladora, para o uso emergencial, ou seja, para uso destinado a imunização de grupos de risco, como indígenas, idosos e profissionais de saúde.
Caso a Anvisa dê aval para o uso emergencial das vacinas, o Brasil já poderá, em tese, aplicar os imunizantes. A medida, no entanto, valerá a partir do momento em que a decisão for publicada no DOU (Diário Oficial da União), o que pode ocorrer ainda neste domingo.
O início da imunização dependerá, porém, da organização da campanha e da logística de distribuição de doses. A expectativa do Ministério da Saúde é começar a vacinação nesta semana. Em São Paulo, o secretário de Saúde, Jean Gorinchteyn, afirmou ontem que o estado teria condições de começar imediatamente.
O Instituto Butantan afirma ter à disposição 10,8 milhões de doses da vacina Coronavac em solo brasileiro. No final de março, a carga total de imunizantes disponibilizados pelo instituto está estimada em 46 milhões de doses.
Já a Fiocruz aguarda a chegada de 2 milhões de doses de vacina AstraZeneca/Oxford importadas da Índia. Na última sexta-feira, o governo indiano frustrou as expectativas do Planalto após afirmar que não pode atender demanda brasileira agora.
Para imunização, ambas as vacinas precisam de dose dupla.
Não deixe de curtir nossa página no Facebook, siga no Instagram e também no X.



















Faça um comentário