Brasil
Anvisa autoriza a importação de 6 milhões de doses da vacina Coronavac pelo Butantan
A liberação do imunizante, da chinesa Sinovac, ocorre um dia após o diretor do instituto afirmar que a Anvisa estaria retardando a importação excepcional de matéria-prima que possibilitará a fabricação da vacina no Brasil.
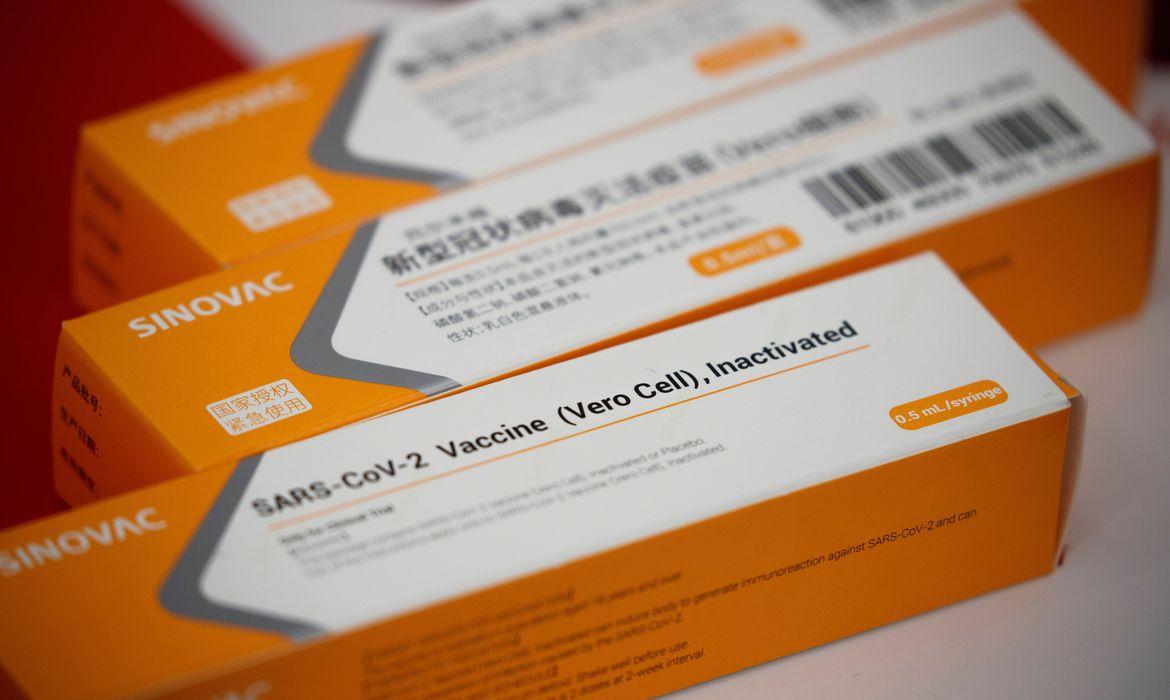
A Anvisa (Agência Nacional de Vigilância Sanitária) autorizou nesta sexta-feira (23) a importação excepcional, pelo Instituto Butantan, de 6 milhões de doses da vacina Coronavac, produzida pela empresa chinesa Sinovac. O aval, porém, não indica que as doses poderão ser aplicadas. Isso ainda dependerá do resultado dos testes clínicos e do registro da vacina no País. As informações são do jornal Folha de S.Paulo.
A decisão ocorre um dia após o diretor-geral do instituto, Dimas Covas, afirmar que a Anvisa estaria retardando a autorização para a importação excepcional de matéria-prima da Sinovac que possibilitará a fabricação da vacina no Brasil.
O pedido, feito em 23 de setembro, incluía também o recebimento de 6 milhões de doses de vacinas já prontas pela empresa chinesa. O plano original do Butantan era receber essas doses em outubro e fabricar no Brasil, até dezembro, as outras 40 milhões de doses a partir da matéria-prima que chegaria da China.
Na quinta, porém, Covas disse à Folha ter recebido a informação de que o assunto só seria tratado em uma reunião em 11 de novembro. “Uma liberação que ocorre em dois meses deixa de ser excepcional”, afirmou.
Nesta semana, o presidente Jair Bolsonaro esvaziou o plano do Ministério da Saúde de compra futura de doses da Coronavac, criticou o governador João Doria (PSDB-SP) e disse que a vacina não seria confiável por causa de sua origem.
Inicialmente, a Anvisa não respondeu sobre os motivos do atraso e informou apenas que o pedido foi incluído em uma ferramenta especial de análise, chamado de circuito deliberativo, com previsão de decisão em até cinco dias.
Publicado nesta sexta, o aval para importação das 6 milhões de doses representa, assim, uma parte da decisão sobre o processo. Falta, ainda, a análise da importação de matéria-prima, prevista para ocorrer em reunião marcada para o dia 4 de novembro.
Mais cedo, a Anvisa negou ter atrasado a análise e afirmou que o processo já havia sido analisado, mas que “foram identificadas discrepâncias”. O órgão não disse quais. Em meio a polêmica, a decisão que libera a importação das doses de vacinas foi aprovada por unanimidade entre os diretores da Anvisa.
No texto que traz o aval, a agência reforça que “a utilização do produto ficará condicionada à obtenção de seu registro sanitário junto à Anvisa”, ou seja, após a conclusão dos testes clínicos e a solicitação do aval. Até lá, a carga deverá ficar sob guarda do Instituto Butantan, “que deverá mantê-la em suas instalações e em perfeitas condições de acondicionamento até que seja autorizada a utilização”.
Não deixe de curtir nossa página no Facebook, siga no Instagram e também no X.



















Faça um comentário