Brasil
Vacina de Oxford contra Covid-19 testada no Brasil pode ter uso emergencial em 2020
A professora Lily Yin Weckx, coordenadora dos estudos da vacina na Unifesp, afirmou que o contexto da pandemia contribui para a agilidade nas pesquisas caso os dados da atual fase de estudos da fórmula indiquem sua eficácia.
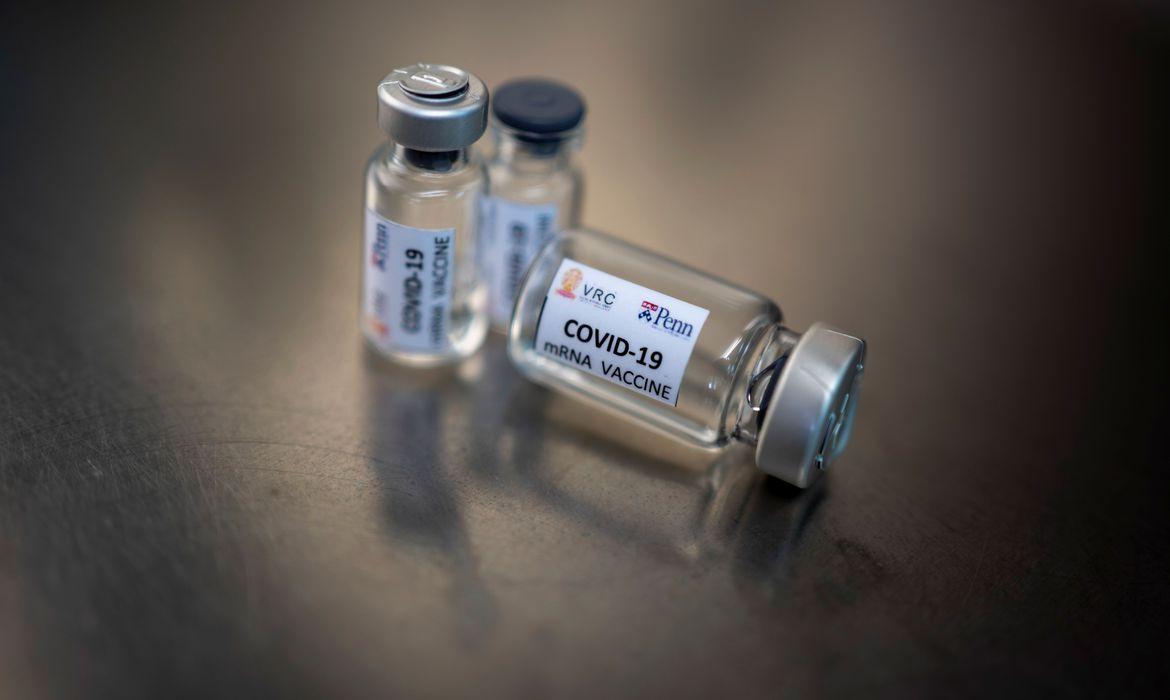
A vacina contra o novo coronavírus desenvolvida pela Universidade de Oxford (Reino Unido) e testada no País pela Universidade Federal de São Paulo (Unifesp) pode ser licenciada para uso emergencial ainda este ano caso os dados da atual fase de estudos indiquem sua eficácia. De acordo com a professora Lily Yin Weckx, coordenadora dos estudos da vacina na Unifesp, o contexto da pandemia contribui para a agilidade nas pesquisas. As informações são do jornal O Globo.
O estudo completo só deve ser finalizado em junho do ano que vem. A pesquisadora participou do I Congresso WebHall da Escola Paulista de Medicina, focado nas pesquisas sobre a doença. A última e terceira fase de testes clínicos está em curso no País e busca definir se a vacina é eficaz contra a Covid-19. No Brasil, pelo menos 5 mil voluntários da área de saúde participam do estudo, 2 mil deles apenas no estado de São Paulo.
“Qual a nossa perspectiva? Se formos seguir todos os passos de desenvolvimento da pesquisa, o estudo vai terminar em junho do ano que vem. Mas o que se espera é que, como temos vários centros estudando, com um grande número de pessoas sendo avaliadas, é que possamos fazer uma análise interina dos dados. Se essa análise mostrar que o resultado é muito positivo, é possível conseguir o licenciamento para uso emergencial”, afirmou a médica.
Durante sua apresentação, a médica fez um panorama geral de todas as pesquisas de desenvolvimento de vacinas ao redor do mundo. Além das doses sendo produzidas em Oxford, o Brasil também participa de testes de outras quatro vacinas, incluindo aquela produzida pela chinesa Sinovac, em parceria com o Instituto Butantan. Nesta semana, o estado do Paraná anunciou uma parceria com a Rússia para os testes com a vacina anunciada pelo presidente do país, Vladimir Putin. A OMS, entretanto, ainda não garante a eficácia da vacina produzida no país.
“O nosso estudo está indo muito bem e pretendemos em breve ter dados de eficácia da vacina. E essa corrida não é para ver quem vai chegar primeiro: é uma corrida contra o vírus. Para atender à humanidade, precisaremos de mais uma vacina, para assegurar que ela seja acessível para todos e não apenas para os países mais ricos”, afirmou Lily Yin Weckx.
Nesta semana, foi autorizada a participação de voluntários acima de 60 anos nos estudos da vacina de Oxford. Além disso, a pesquisa que previa a aplicação de apenas uma dose nos voluntários agora irá aplicar uma segunda dose. A mudança foi feita após a divulgação, no final de julho, dos resultados prévios da fase dois, que demonstraram a segurança de uso nos idosos e também o potencial de produção de anticorpos após a segunda dose.
A dose de reforço deve ser dada aos participantes após quatro semanas da aplicação inicial. Os voluntários que já passaram pelo estudo deverão ter a segunda dose no intervalo de quatro a seis semanas. O prazo mais alongado é necessário para que haja tempo de fazer contato com o voluntário e trazê-lo de volta à pesquisa.
“Todas essas modificações vão de encontro à nossa realidade. A vacina, se for licenciada, se ela se mostrar eficaz, com certeza ela será priorizada para os grupos de risco como profissionais de saúde e idosos. Cada vez mais o protocolo vai se aproximando da realidade que teremos”, afirmou.
Segundo a professora, as mudanças anunciadas fazem parte de uma pesquisa que precisa ser realizada “na velocidade de uma pandemia”. Normalmente, pesquisas para o desenvolvimento de vacinas podem demorar vários anos até serem finalizadas. No caso da Covid-19, as fases clínicas precisam ser realizadas ao mesmo tempo.
“A velocidade com que estamos desenvolvendo as vacinas é necessária para encararmos a nossa realidade. Não podemos esperar terminar a fase 1 para depois terminar a fase 2. Em tempos normais talvez pudesse esperar. Mas à medida que saíram dados de segurança na outra faixa etária, mudamos o protocolo. Mas o importante é: não se pulou nenhuma etapa, principalmente de segurança. Nessa fase Anvisa, Conep, todo o sistema regulatório de Brasil tem colaborado na sua agilidade, mas a exigência continua a mesma”, afirmou Weckx.
Não deixe de curtir nossa página no Facebook, siga no Instagram e também no X.



















Faça um comentário