Brasil
Anvisa cobra mais dados do Butantan para uso emergencial da Coronavac
A agência declarou que na triagem dos documentos do instituto faltaram informações para autorizar aplicação do imunizante produzido pela empresa chinesa Sinovac.
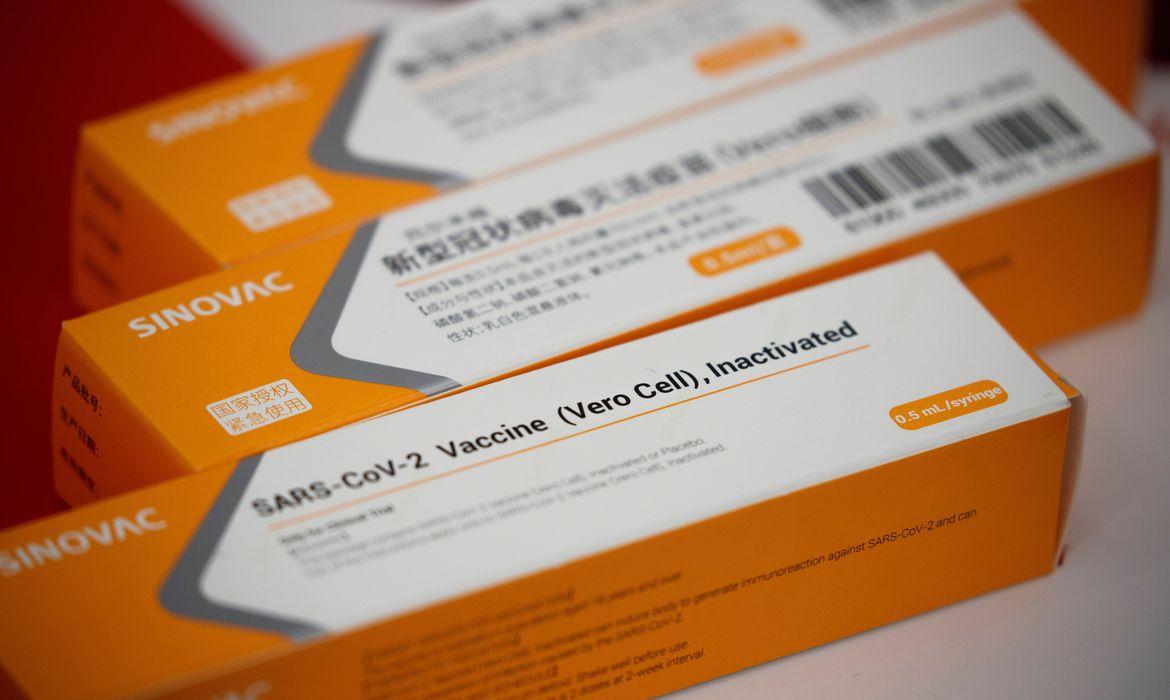
A Anvisa (Agência Nacional de Vigilância Sanitária) afirmou neste sábado (9) que Fiocruz enviou todos os documentos para análise do uso emergencial da vacina contra o coronavírus e cobra mais dados do Butantan. As informações são do jornal Folha de S.Paulo.
O posicionamento da agência reguladora foi feito após concluir a triagem inicial dos documentos submetidos pela Fiocruz e pelo Instituto Butantan para o uso emergencial da vacina contra a Covid-19.
A checagem é uma conferência feita nas primeiras 24 horas para verificar se as informações essenciais sobre eficácia e resultados clínicos estão no processo para análise de uso emergencial pela equipe técnica da Anvisa.
De acordo com a triagem feita pelos técnicos da Anvisa, o pedido da Fiocruz traz os documentos preliminares e essenciais para a avaliação detalhada da Agência. A partir de agora, a equipe técnica vai se aprofundar na análise dos dados e informações apresentadas.
Já na triagem feita nos documentos do Instituto Butantan, os técnicos da Anvisa verificaram que ainda faltam dados necessários à avaliação da autorização de uso emergencial.
“A partir da triagem, a Anvisa enviou hoje (9) ofício ao Instituto Butantan solicitando a apresentação dos documentos técnicos faltantes, previstos no Guia 42/2020 (Requisitos para submissão de solicitação de autorização temporária de uso emergencial Vacinas – COVID-19), bem como nos regulamentos técnicos da Agência. O recebimento do ofício foi confirmado pelo Butantan às 11h29 de hoje”, disse.
A submissão dos documentos técnicos previstos no Guia é condição necessária para viabilizar a avaliação, conclusão e a deliberação sobre a autorização de uso emergencial das vacinas.
As equipes técnicas da Anvisa e do Instituto Butantan já realizaram duas reuniões tratar da questão. A agência reguladora disse que faltam seis tipos de informações e resultados.
Na ocasião, o Instituto foi informado sobre a necessidade dos documentos complementares, essenciais à análise e conclusão sobre a eficácia e segurança da vacina. Foram discutidos também prazos e cronogramas para a apresentação dos dados faltantes.
O Instituto Butantan informou à Anvisa que apresentará os dados com brevidade. A Agência disse que continuará a avaliar a documentação que já foi enviada, de forma a otimizar esforços para uma decisão célere sobre o pedido.
Entre os dados que faltam estão as características demográficas e basais críticas da população do estudo. São dados básicos com as características de todos os voluntários testados como idade, sexo, raça, peso e índice de massa corporal dos participantes. Também são necessários dados de outras características importantes, por exemplo, função renal ou hepática e comorbidades
“Os dados são fundamentais para permitir a comparação entre grupos tratados”, disse em nota.
Além dos resultados do estudo por população de “intenção-de-tratamento” (ITT). É um dado mais complexo e detalhado da população que seria alvo da vacinação.
Há ainda os dados sobre a disposição dos participantes, com uma contabilidade clara de todos os participantes. Isso significa ter os números exatos sobre voluntários, doses recebidas e número de voluntários que completaram estudo.
O quarto dado seria a descrição dos desvios de protocolo. É o detalhamento sobre qualquer coisa feita de forma diferente do que estava no protocolo de pesquisa ou que não estava programada.
O outro seria a listagem de participantes com desvios de protocolo. É a lista detalhada de pacientes que tiveram algum tipo de desvio de protocolo. Além dos dados de imunogenicidade do estudo fase 3. É o estudo que verifica os anticorpos gerados pela vacina e por quanto tempo estes anticorpos permanecem nos voluntários.
Em nota, o Butantan afirmou que segue fornecendo todos os documentos necessários para a Anvisa, e que o pedido da agência “não afeta o prazo previsto para autorização de uso do imunobiológico”.
“Os pedidos de novos documentos ou mais informações são absolutamente comuns em processos como esses”, diz o instituto.
O Instituto Butantan e a Fiocruz enviaram na sexta-feira (8) à Anvisa os primeiros pedidos para uso emergencial da vacina contra o novo coronavírus no Brasil.
A primeira solicitação foi feita pelo Instituto Butantan que tem uma parceria com a empresa chinesa Sinovac para produzir a Coronavac.
Horas depois, pedido semelhante foi registrado pela Fiocruz, instituto que representa, no Brasil, a vacina de Oxford, desenvolvida pela farmacêutica AstraZeneca e Universidade de Oxford.
Hoje, tanto a vacina da Fiocruz quanto a do Butantan são tidas como as principais apostas para iniciar a vacinação no Brasil.
A vacina de Oxford, no entanto, foi a primeira a ter um acordo fechado com o governo federal, enquanto a Coronavac esteve no centro de uma guerra política entre Bolsonaro e Doria nos últimos meses.
O Ministério da Saúde anunciou neste sábado (9) que fechou acordo com o Instituto Butantan de exclusividade na distribuição da Coronavac pelo SUS. A vacina será disponibilizada simultaneamente a todos os estados.
Segundo a pasta, o contrato de exclusividade centraliza compra e distribuição da vacina contra o novo coronavírus pelo Ministério da Saúde. Dessa forma, impede que o imunizante seja comercializado entre o Instituto Butantan e estados.
Com a medida, a ideia do governo é que brasileiros de todo o país recebam a vacina simultaneamente.
Independentemente dos prazos, o uso emergencial das vacinas, caso concedido pela Anvisa, deve envolver um número menor de doses em relação ao previsto para ser produzido pelos dois laboratórios para os próximos meses.
No caso do Butantan, o pedido de uso emergencial vale para 6 milhões de doses vindas da China e que estão sob guarda do instituto desde 2020.
Já o pedido feito pela Fiocruz vale para 2 milhões de doses que devem ser importadas do Serum Institute, na Índia, um dos centros de produção da vacina de Oxford para outros países.
Ainda não há previsão de data para entrega dessas doses. A Fiocruz diz esperar que isso ocorra “nos próximos dias”. Nos bastidores, porém, representantes do Ministério da Saúde correm para tentar obter o material até a próxima semana.
A tentativa de importação começou a ser negociada pela pasta ainda em dezembro. Inicialmente, Fiocruz previa entregar as primeiras doses previstas em acordo com a AstraZeneca a partir de 8 de fevereiro –no total, são 100 milhões de doses no primeiro semestre, e 110 milhões no segundo.
Alvo de críticas pela demora em iniciar a vacinação, o ministério pretende usar as doses importadas para iniciar a vacinação no dia 20 de janeiro –cinco dias antes da data prevista pelo governo paulista.
Não deixe de curtir nossa página no Facebook, siga no Instagram e também no X.



















Faça um comentário