Brasil
Anvisa aprova registro de segundo autoteste para Covid-19 vendido em farmácias no Brasil
Disponibilidade no mercado agora depende da empresa produtora.

A comercialização e o uso do auto-teste dependem de autorização da Anvisa. (Foto:Reprodução)
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o registro do segundo autoteste para a Covid-19 no Brasil, segundo divulgação feita nesta quarta-feira (23). A fabricante é a Eco Diagnostica Ltda., que fará o Autoteste COVID Ag Detect no Brasil.
“O produto atendeu aos critérios técnicos definidos pela Agência e também teve o desempenho avaliado e aprovado pelo Instituto Nacional de Controle de Qualidade em Saúde (INCQS), conforme estabelecido no Plano Nacional de Expansão da Testagem (PNE) do Ministério da Saúde”, afirmou a Anvisa.
O primeiro autoteste para a Covid-19 — que permite a identificação do vírus em secreções nasais coletadas por um cotonete e submetido a processos químicos — foi aprovado no Brasil no dia 17 de fevereiro.
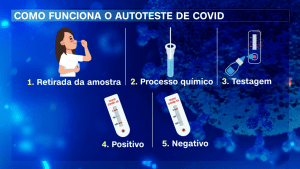
Arte/CNN
De forma geral, o paciente que possui o kit realiza a coleta através da secreção do nariz ou da boca com um cotonete. Na sequência, a haste é introduzida em um processo químico e colocada para a testagem. O resultado está disponível em menos de meia hora, no geral, indicando tanto o resultado positivo quanto negativo para a presença do vírus.
Para atender aos requisitos listados pela Anvisa como necessários para a aprovação, o segundo autoteste levou 22 dias de análise e atendimento de exigências listadas, além de uma reunião técnica para a apresentação de informações, informou a agência.
Outros pedidos
Com a aprovação, fica permitida a venda dos exames por farmácias e estabelecimentos de saúde licenciados para comercializar dispositivos médicos.
No entanto, a comercialização, distribuição e o uso no país dependem de a Anvisa autorizar empresas produtoras dos autotestes.
É possível acompanhar cada pedido no painel da Anvisa, que ainda não foi atualizado com a recente aprovação.
Requisitos para o registro
Entre os requisitos para conceder o registro, a Anvisa determina que os produtos devem apresentar instruções de uso, armazenagem e descarte. As informações precisam contar com uma linguagem simples e com ilustrações, para facilitar o manuseio e a interpretação do resultado.
Com relação à embalagem, as orientações da Anvisa informam que o rótulo externo do produto deve conter todos os componentes do kit que são necessários para a realização do teste, além da validade do dispositivo.
Além disso, o fabricante deve oferecer um canal de atendimento ao usuário para orientar e encaminhar as demandas sobre o uso do produto e como proceder após a obtenção do resultado.
Segundo a Anvisa, além de disponibilizar o contato desse serviço de atendimento, a empresa deve indicar o serviço Disque Saúde do Ministério da Saúde, de acordo com as recomendações do Plano Nacional de Expansão da Testagem para Covid-19, o PNE-Teste.
Com informações da CNN Brasil.
Não deixe de curtir nossa página no Facebook, siga no Instagram e também no X.



















Faça um comentário