Notícias
Instituto Butantan detecta variante BN.1 da Ômicron pela primeira vez no Brasil
Caso foi encontrado na cidade de São Paulo; sublinhagem afeta principalmente os Estados Unidos, a Europa e a Austrália.
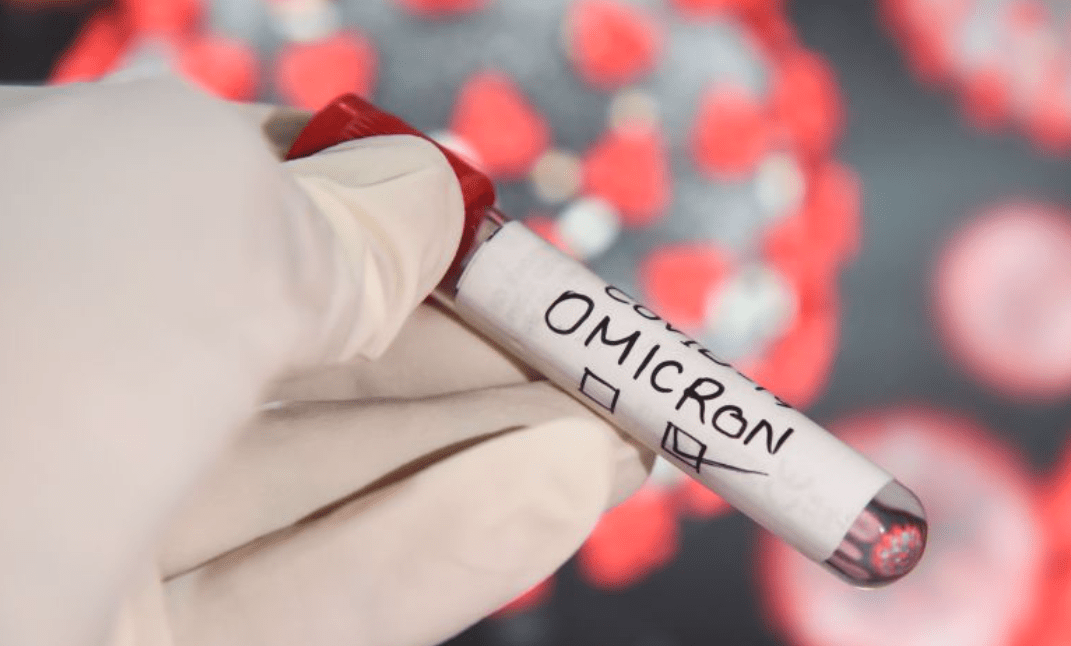
O Instituto Butantan detectou pela primeira vez no Brasil a sublinhagem BN.1 da variante Ômicron do coronavírus. A amostra foi coletada em 27 de outubro em uma mulher de 38 anos moradora da cidade de São Paulo.
A nota do instituto informa que a sublinhagem foi “descrita primeira vez no sistema Pango de linhagens do SARS-CoV-2 na Índia” em 28 de julho.
Atualmente, a maior incidência dessa sublinhagem acontece nos Estados Unidos (16% de todas as amostras de BN.1 encontradas no mundo), no Reino Unido (15%), Áustria (14%), Austrália (14%) e Índia (11%).
Os especialistas do Butantan pontuam, no entanto, que ela não é uma variante de preocupação, ou seja, não é monitorada pela Organização Mundial da Saúde e “não deve causar grande impacto”.
Eles complementam que há várias novas variantes em circulação no estado de São Paulo, mas que não têm força suficiente para sobrepor a BQ.1.1.
Anvisa
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, nesta segunda-feira (21), o uso pediátrico do Remdesivir contra a Covid-19. A publicação que confirma a ampliação será publicada em edição extra do Diário Oficial da União.
Conforme definição da Agência, também poderão receber o remédio “bebês e crianças a partir de 28 dias e peso igual ou superior a 3 kg, com pneumonia que requerem administração suplementar de oxigênio (oxigênio de baixo ou alto fluxo, ou outra ventilação não invasiva no início do tratamento)”.
Outro grupo contemplado é o de crianças com menos de 40 kg que não precisem de oxigênio suplementar, mas que têm maior risco de desenvolver a forma grave da doença.
Outra aprovação feita pela Anvisa nesta segunda-feira (21) foi a venda do Paxlovid, um medicamento para tratamento da Covid-19 para adultos, em farmácias e hospitais particulares. A compra só poderá ser feita com receita.
Assim, o fornecimento do medicamento para o mercado privado está autorizado, com a rotulagem e bula em português de Portugal e em espanhol. A Agência destacou, porém, que o fabricante deverá manter e priorizar o abastecimento do Sistema Único de Saúde (SUS).
A aprovação aconteceu por unanimidade da diretoria colegiada do órgão, que também confirmou a ampliação da validade do medicamento de 12 meses para 18 meses.
Não deixe de curtir nossa página no Facebook, siga no Instagram e também no X.



















Faça um comentário