Brasil
Testes da vacina de Oxford contra a Covid-19 são paralisados por reação adversa
A farmacêutica AstraZeneca, que desenvolve a vacina experimental junto com a universidade do Reino Unido, pausou os estudos na fase 3 como protocolo de segurança; dados sobre imunização ainda serão verificados.
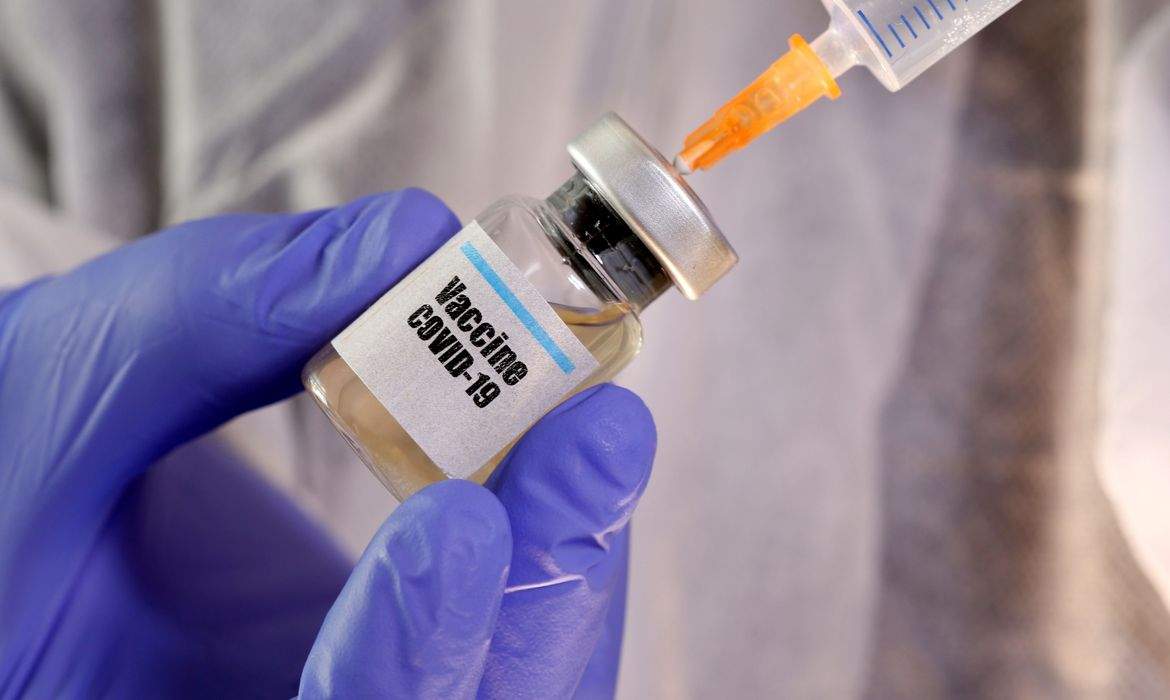
O estudo da vacina contra a Covid-19 da Universidade de Oxford, do qual o Brasil participa através de parceria com a Fiocruz, foi pausado. A informação foi inicialmente divulgada pela Stat, veículo especializado em saúde e tecnologia, que a recebeu da própria AstraZeneca, e confirmada pela Anvisa e pela Fiocruz. As informações são do jornal Folha de S.Paulo.
Segundo o comunicado da farmacêutica, os testes da imunização foram paralisados para verificação de dados sobre segurança da vacina. “Esse é um processo de rotina que precisa acontecer conforme sejam detectados potenciais problemas em um dos braços de teste”, afirma a AstraZeneca.
A Anvisa (Agência Nacional de Vigilância Sanitária) afirma que a decisão de pausar os estudos veio do laboratório, que, em seguida, comunicou os países participantes. A agência aguarda mais informações para se pronunciar oficialmente.
A farmacêutica diz ainda que, em estudos com participação de muitas pessoas, como é o caso da fase três da vacina em questão, problemas de saúde ocorrerão aleatoriamente, mas tais casos precisam ser analisados por uma equipe independente.
O comunicado também não deixa claro em qual braço do estudo ocorreu o evento, se não que recebeu a vacina ou no que recebeu placebo. A pausa pode impactar o cronograma de conclusão do estudo. A farmacêutica afirma que está trabalhando para revisar o evento encontrado e minimizar qualquer potencial impacto nos prazos inicialmente programados.
Raquel Stucchi, pesquisadora da Unicamp e membro da SBI (Sociedade Brasileira de Infectologia), afirma que o caso mostra a importância da fase três, com um número de pessoas grande, do estudo com vacinas, consideração que vem sendo repetidamente destacada por pesquisadores. “Isso mostra que temos que ter cautela. A vacina não é para amanhã, nenhuma delas é”, diz Stucchi.
A pesquisadora também elogiou a ação da AstraZeneca de seguir o protocolo, comunicar o problema e paralisar o estudo. Ela lembra dos vultuosos investimentos para desenvolvimento da imunização e da pressão para acelerar o processo até a aprovação.
Nesta terça-feira (8), o ministro interino da saúde, Eduardo Pazuello, afirmou que “em janeiro do ano que vem, a gente começa a vacinar todo mundo”. Segundo Pazuello, a previsão as primeiras doses da vacina chegassem ao governo brasileiro no mês em questão.
Nos EUA, o governo levantou a possibilidade para vacinar parte da população já em outubro, data próxima à eleição presidencial na qual o presidente republicano Donald Trump tenta reeleição e antes mesmo da conclusão da fase 3 dos estudos.
A situação mostra que não é possível definir uma data para a disponibilização da vacina antes do fim dos testes, diz Isabella Ballalai, vice-presidente da SBIm (Sociedade Brasileira de Imunizações). “Buscar fazer rápido é diferente de pular etapas”, afirma.
As especialistas também afirmam que é necessário esperar a investigação para que se confirme ou não a relação entre o evento adverso e a vacina. Isso porque a notificação do evento é feita pela proximidade com a aplicação da imunização, mas pode não ter sido causado por ela.
A paralisação, portanto, faz parte de protocolo de segurança. “Essa situação que aconteceu não é uma novidade em pesquisa de vacina ou de medicamento. É uma coisa que pode acontecer”, diz Ballalai.
A preocupação surge se realmente for confirmado que o evento adverso foi causado pela vacina. A Folha procurou a AstraZeneca no Brasil, mas a farmacêutica no País ainda não tem um posicionamento oficial. A empresa havia recebido aval da Anvisa (Agência Nacional de Vigilância Sanitária) em junho para testes também no Brasil.
A medida também pode afetar o cronograma de um acordo com o Ministério da Saúde e a Fiocruz para transferência de tecnologia e produção da vacina também no Brasil.
O acordo prevê a oferta de 100,4 milhões de doses da vacina. Destas, 30,4 milhões estariam disponíveis até janeiro, e o restante nos meses seguintes. O governo abriu um crédito orçamentário de R$ 1,9 bilhão para que a Fiocruz pudesse receber as primeiras doses e participar da produção da vacina.
Em nota, a Fiocruz disse que foi informada pela AstraZeneca sobre a suspensão dos testes clínicos em fase 3 e vai acompanhar os resultados das investigações sobre possível associação de efeito registrado com a vacina para se pronunciar oficialmente. A reportagem procurou o Ministério da Saúde para comentar sobre o caso, mas ainda não recebeu resposta.
Não deixe de curtir nossa página no Facebook, siga no Instagram e também no X.



















Faça um comentário